제품 판매중지 및 회수조치, 시술환자에게는 안전정보 안내
[시사포커스 / 이영진 기자] 식품의약품안전처는 대동맥류나 대동맥 박리증 등 혈관질환에 사용되는 의료기기인 혈관용 스텐트를 허가사항과 다르게 제조하고 유통한 의료기기 업체 ‘에스엔지바이오텍’을 적발하고 행정처분 및 고발조치하였다고 23일 밝혔다.
혈광용 스텐트란 혈관의 폐색부위에 삽입하여 개통을 유지, 확장하는 의료기기다.
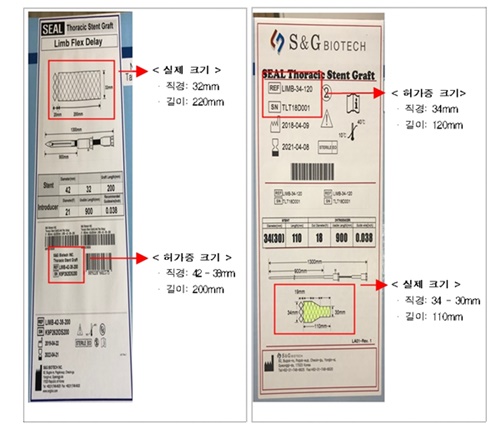
식약처는 점검 결과 2014년 이후 길이, 직경, 모양 등이 허가사항과 다른 혈관용 스텐트 약 4300여개를 생산하여 대학병원 등 136개 의료기관에 납품해 온 사실이 확인됐다고 전했다.
제품 포장에는 허가받은 모델명을 거짓으로 기재하고 의료기관이 제품을 구분하여 사용할 수 있도록 실제 제품도면을 추가로 기재하는 방식으로 납품했다.
한편 식약처는 시술환제에게 제품에 대한 안전성 정보 등을 안내하고자 한국의료기기안전정보원, 보건복지부, 건강보험심사평가원 등 관련기관과 함께 시술환자의 정확한 현황을 파악 중이며 의료기관이 환자에게 개별 통보하도록 조치할 계획이라고 전했다.
관련기사
이영진 기자
sisafocus02@sisafocus.co.kr


